Estructura espacial de los complejos
Las estructuras moléculares en la química de coordinación se encuentran primeramente descriptas por el número de coordinación, es decir por el número de ligandos unidos al grupo central (más específicamente, al número de enlaces sigma entre ligandos y grupo central). Normalmente es posible contar los ligandos unidos, pero algunas veces la cuenta de ligandos puede tornarse un poco ambigua. El número de coordinación se encuentra normalmente comprendido entre uno y nueve, pero no son extraños números de coordinación aun mayores para los lantánidos y actínidos. El número de coordinación va a depender del tamaño, carga, y configuración electrónica del grupo central y de los ligandos.
Los iones metálicos pueden presentar más de un número de coordinación.
La química de los complejos se encuentra dominada por las interacciones entre los orbitales moleculares s y p del ligando y los orbitales d de un ion metálico central. En conjunto los orbitales s, p y d del ion central pueden acomodar 18 electrones (ver la regla de 18 electrones), aunque para elementos del bloque f, esta regla se extiende hasta 32 electrones. El número máximo de coordinación para determinado elemento se encuentra por lo tanto relacionado con su configuración electrónica, (más específicamente con el número de orbitales vacíos que posee), y a la relación entre el tamaño de los ligandos y del grupo central. Grupos centrales grandes y ligandos pequeños permiten números de coordinación elevados, por ejemplo el [Mo(CN)8]4-. Grupos centrales pequeños y ligandos de gran tamaño tienden a desarrollar números de coordinación pequeños, por ejemplo Pt[P(CMe3]2. Es debido precisamente a su gran tamaño, que los lantánidos, actínidos y primeros elementos de transición tienden a desarrollar números de coordinación elevados.
De los diferentes números de coordinación resultan diferentes arreglos estructurales. La mayoría de las estructuras siguen un patrón cuasiesférico, (o, visto de otro modo, como si el grupo central se encontrara en medio de un poliedro y los grupos ligandos se ubicaran en los vértices del mismo). Es en estos puntos donde es posible que se produzca el solapamiento entre los orbitales de los ligandos y el grupo central. Las repulsiones ligando-ligando tienden a dirigir esta organización hacia determinadas geometrías regulares que minimizan las interferencias. Hay sin embargo, numerosos casos de desviaciones de estas organizaciones regulares, por ejemplo en los casos donde se unen ligandos de diferentes tipos, lo que causa diferentes longitudes de enlace, apartando a los ligandos de su organización cuasiesférica, o cuando se producen distorsiones por efectos electrónicos, por ejemplo en la distorsión de Jahn-Teller.
Geometría
Para los números de coordinación entre dos y nueve los arreglos geométricos más comunes que se presentan en complejos son aquellos que tienden a minimizar las fuerzas de repulsión entre orbitales de la capa de valencia
Se deben notar sin embargo algunas excepciones y previsiones:
- La descripción idealizada para números de coordinación 5, 7, 8 y 9, a menudo es geométricamente indistinta de estructuras alternativas con ángulos L-G-L (ligando-Grupo central-Ligando) ligeramente distintos. El ejemplo clásico de esto es la diferencia entre las estructuras piramidal cuadrada y bipiramidal trigonal.
- Debido a algunos efectos electrónicos especiales, tales como la estabilización de segundo orden Jahn-Teller, ciertas geometrías se ven favorecidas frente a otras estructuras posibles. Por ejemplo, para algunos compuestos con número de coordinación seis, la geometría prismática trigonal se ve favorecida por estabilización y es la adoptada por el complejo en lugar de la octaédrica.
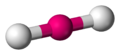
Lineal
La Lineal es la estructura de menor energía para un número de coordinación dos. En esta disposición el grupo central se encuentra entre los dos grupos ligandos y los tres forman una línea con un ángulo de enlace L-G-L de 180º
Trigonal plana
La geometría molecular trigonal plana es la estructura que minimiza las interacciones para un número de coordinación tres. En esta disposición el grupo central se encuentra en el centro de un triángulo equilátero y los grupos ligandos se ubican en los vértices del mismo, con un ángulo de enlace L-G-L de 120º
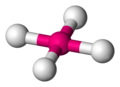
Tetraédrica
La estructura tetraédrica es la de menor energía posible para un número de coordinación cuatro. En esta disposición el grupo central se encuentra en medio de un tetraedro regular y los grupos ligandos se ubican en los vértices del mismo con un ángulo de enlace L-G-L de 109,5º
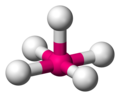
Plano cuadrada
La geometría molecular plano cuadrada es otra estructura posible para un número de coordinación cuatro, en esta los cuatro ligandos se disponen en un mismo plano en los vértices de un cuadrado. Aparentemente es de energía mayor que la tetraédrica ya que los ángulos L-G-L son de 90º, pero aquí participan repulsiones debidas a orbitales con pares solitarios que se encuentran en las posiciones polares (los pares están en un plano perpendicular al plano que comparten las moléculas en disposición cuadrada). Los metales con configuración electrónica nd8 tienden a adoptar la geometría cuadrada plana.
Bipiramidal trigonal
La geometría molecular bipiramidal trigonal es la que maximiza los ángulos de separación, y por lo tanto minimiza la energía para un número de coordinación de cinco. se puede ver como dos tetraedros unidos por la base y está muy próxima en energía a su isocoordinada. Esta disposición es anisotrópica, los ligandos en posición ecuatorial se encuentran separados 120º entre sí, pero un ligando ecuatorial se encuentra separado 90º de uno polar.
Piramidal cuadradado
La geometría molecular piramidal cuadrada se obtiene desplazando ligeramente uno de los vertices polares de una bipirámide trigonal hasta dejarlo en el mismo plano que el formado por dos de los vertices ecuatoriales y el restante vértice polar.
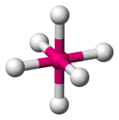
Octaédrica
La octaédrica es la más típica disposición geométrica para los elementos de transición, y no resulta difícil ver porqué, si pusiéramos una esfera en el interior de un cubo (esfera inscrita), la esfera tocaria las caras del cubo en los vértices de un octaedro. Esta disposición consta de cuatro ligandos colocados en un mismo plano (llamado plano ecuatorial) y un ligando a cada uno de los lados de ese plano en “posición polar”, en esta estructura el mínimo ángulo entre ligandos es de 90º.
Prismática trigonal
La geometría molecular prismática trigonal es la siguiente en estabilidad para un número de coordinación seis, suele ser de menor estabilidad porque implica que los ligandos de los vértices del prisma queden enfrentados unos a otros, esta interferencia se minimiza en la disposición octaédrica (que en cierta forma podría ser considerada un antiprisma trigonal, donde se ha girado la cara superior para que los vértices no queden enfrentados). Por lo general esta estructura se presenta por una estabilización debida a algún otro factor no exclusivamente geométrico, por ejemplo por distorsión forzada de orbitales.
Bipiramidal pentagonal
La configuración bipiramidal pentagonal es la preferida para un número de coordinación siete, como su nombre lo indica se puede ver como dos pirámides de base pentagonal unidas por la base.
Antiprismática cuadrada
La geometría molecular antiprismática cuadrada es la configuración de menor energía entre las tres posibles configuraciones para un número de coordinación ocho, se puede pensar como un cubo en el que se ha girado la cara superior para que los vértices no queden enfrentados.
Bipiramidal hexagonal
La estructura molecular bipiramidal hexagonal es la siguiente en estabilidad para un número de coordinación ocho.
Tetraédrica triapicada
La estructura molecular tetraédrica triapicada es una estructura muy extraña entre los metales de transición, pero para elementos de transición interna resulta ser la estructura que minimiza todas las interacciones entre ligandos y las distorsiones orbitales por lo que se presenta incluso en compuestos muy sencillos tales como el ThCl4. Puede ser racionalizado como un dodecaedro de caras triangulares.
Cúbica
Es la geométricamente menos estable de las configuraciones para el número de coordinación ocho y prácticamente no existe para los elementos de transición, aunque parece ser bastante común entre los elementos de transición interna, principalmente debido a que los orbitales f(xyz) apuntan hacia los vértices de un cubo, lo que disminuye la distorsión de estos orbitales al interactuar con los ligandos.
Prismática trigonal triapicada
La Prismática trigonal triapicada es la geometría más regular y estable que existe para un número de coordinación nueve. La aproximación más sencilla para comprender esta estructura tridimensional es imaginarse un prisma trigonal y a media altura insertar un triángulo de modo que los vertices de este queden apuntando al centro de las caras cuadradas del prisma.
Índices de coordinación superiores a 9
Aunque más de las dos terceras partes de los complejos conocidos presentan índices de coordinación entre 6 y 9, se conocen algunos ejemplos de lantánidos y actínidos con índices de coordinación superiores: 10, 11 ó 12.
El número de coordinación 12 presenta un mayor número de ejemplos que el número de coordinación 10 y son muy pocos los descritos para número de coordinación 11. Sin embargo debe mencionarse que, en todos los casos, son complejos que implican ligandos quelato o macrociclo, no se conocen ejemplos de complejos con índices de coordinación mayores que 9 formados por ligandos monodentados.
Para un número de coordinación 12, cabría esperar una estructura regular con forma icosaédrica. Sin embargo, esta estructura prácticamente no existe en la química práctica. Por el contrario, la gran mayoría de las estructuras descriptas corresponden a tetraedros truncados, cubooctaedros o cubos tetraapicados.
Existen trabajos de química computacional que concluyen que en realidad la mejor manera de plasmar los índices de coordinación superiores a 9 para estas estructuras es mediante esquemas de enlace más simples (tetraedro, bipirámide trigonal u octaedro) y que las estructuras pseudoregulares observadas son en realidad una consecuencia de la interacción de los orbitales del ligando quelato con la gran superficie de los orbitales 4f, 5f, 5d o 6d del grupo central, y no sólo es debida a la coordinación con los átomos dadores.
Galería de geometrías
|
|
 |
 |
|
| Arreglo espacial en un complejo lineal. | Arreglo espacial en un complejo trigonal | Arreglo espacial de un complejo tetraédrico. | Arreglo espacial en un complejo cuadrado plano |
 |
|
 |
 |
| Disposición espacial en un complejo bipiramidal trigonal | Disposición espacial en un complejo piramidal cuadrado | Disposición espacial en un complejo octaédrico | Disposición espacial en un complejo prismático trigonal. |
 |
 |
 |
 |
|
Disposición espacial en un complejo bipiramidal pentagonal |
Disposición espacial en un complejo antiprismatico cuadrado |
El complejo [UO2(Acetato O, O’)3] presenta una geometría bipiramidal hexagonal. | El complejo [Y(OH)8]3+presenta una geometría tetraédrica triapicada. |
 |
|
| ejemplo de geometría prismática trigonal triapicada, los ligandos que apuntan a las caras del prisma aparecen en color oscuro. | El complejo [U(CNS)8]4-presenta una clara geometría cúbica. |