Reducción-oxidación
Se denomina reacción de reducción-oxidación, de óxido-reducción o, simplemente, reacción redox, a toda reacción química en la que uno o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación.
Para que exista una reacción de reducción-oxidación, en el sistema debe haber un elemento que ceda electrones, y otro que los acepte:
- El agente reductor es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir, siendo oxidado.
- El agente oxidante es el elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido.
Cuando un elemento químico reductor cede electrones al medio, se convierte en un elemento oxidado, y la relación que guarda con su precursor queda establecida mediante lo que se llama un «par redox». Análogamente, se dice que, cuando un elemento químico capta electrones del medio, este se convierte en un elemento reducido, e igualmente forma un par redox con su precursor oxidado.
Principio de electro neutralidad
El principio de electro neutralidad de Pauling corresponde a un método de aproximación para estimar la carga en moléculas o iones complejos, Este supone que la carga siempre se distribuye en valores cercanos a 0 (es decir, -1, 0, +1).
Dentro de una reacción global redox, se da una serie de reacciones particulares llamadas semirreacciones o reacciones parciales.
- Semireacción de reducción: 2e– + Cu2+ → Cu0
- Semirreacción de oxidación: Fe0 → Fe2+ + 2e–
o más comúnmente, también llamada ecuación general:
Fe0 + Cu2+ → Fe2+ + Cu0
La tendencia a reducir u oxidar a otros elementos químicos se cuantifica por el potencial de reducción, también llamado potencial redox.
Una titulación redox es una en la que un indicador químico indica el cambio en el porcentaje de la reacción redox mediante el viraje de color entre el oxidante y el reductor.
Oxidación
La oxidación es una reacción química muy poderosa donde un elemento cede electrones, y por lo tanto aumenta su estado de oxidación. Se debe tener en cuenta que en realidad una oxidación o una reducción es un proceso por el cual cambia el estado de oxidación de un compuesto. Este cambio no significa necesariamente un intercambio de iones. Suponer esto -que es un error común- implica que todos los compuestos formados mediante un proceso redox son iónicos, puesto que es en éstos compuestos donde sí se da un enlace iónico, producto de la transferencia de electrones.
Por ejemplo, en la reacción de formación del cloruro de hidrógeno a partir de los gases dihidrógeno y dicloro, se da un proceso redox y sin embargo se forma un compuesto covalente.
Estas dos reacciones siempre se dan juntas, es decir, cuando una sustancia se oxida, siempre es por la acción de otra que se reduce. Una cedeelectrones y la otra los acepta. Por esta razón, se prefiere el término general de reacciones redox.
La propia vida es un fenómeno redox. El oxígeno es el mejor oxidante que existe debido a que la molécula es poco reactiva (por su doble enlace) y sin embargo es muy electronegativo, casi como el flúor.
La sustancia más oxidante que existe es el catión KrF+ porque fácilmente forma Kr y F+.
Entre otras, existen el permanganato de potasio (KMnO4), el dicromato de potasio (K2Cr2O7), el agua oxigenada (H2O2), el ácido nítrico (HNO3), los hipohalitos y los halatos (por ejemplo elhipoclorito de sodio (NaClO) muy oxidante en medio alcalino y el bromato de potasio (KBrO3)). El ozono (O3) es un oxidante muy enérgico:
Br− + O3 → BrO3−
El nombre de “oxidación” proviene de que en la mayoría de estas reacciones, la transferencia de electrones se da mediante la adquisición de átomos de oxígeno (cesión de electrones) o viceversa. Sin embargo, la oxidación y la reducción puede darse sin que haya intercambio de oxígeno de por medio, por ejemplo, la oxidación de yoduro de sodio a yodo mediante la reducción decloro a cloruro de sodio:
2 NaI + Cl2 → I2 + 2 NaCl
Esta puede desglosarse en sus dos semirreacciones corresponden
- 2I− → I2 + 2 e−
- Cl2 + 2 e− → 2 Cl−
Ejemplo
El hierro puede presentar dos formas oxidadas:
- Óxido de hierro (II): FeO.
- Óxido de hierro (III): Fe2O3
Reducción
En química, reducción es el proceso electroquímico por el cual un átomo o un ion gana electrones. Implica la disminución de su estado de oxidación. Este proceso es contrario al de oxidación.
Cuando un ion o un átomo se reducen presenta estas características:
- Gana electrones.
- Actúa como agente oxidante.
- Es reducido por un agente reductor.
- Disminuye su estado o número de oxidación.
Ejemplo
El ion hierro (III) puede ser reducido a hierro (II):
Fe3+ + e− → Fe2+
En química orgánica, la disminución de enlaces de átomos de oxígeno a átomos de carbono o el aumento de enlaces de hidrógeno a átomos de carbono se interpreta como una reducción. Por ejemplo:
- CH≡CH + H2 → CH2=CH2 (el etino se reduce para dar eteno).
- CH3–CHO + H2 → CH3–CH2OH (el etanal se reduce a etanol).
Número de oxidación
La cuantificación de un elemento químico puede efectuarse mediante su número de oxidación. Durante el proceso de oxidación, el número de oxidación del elemento aumenta. En cambio, durante la reducción, el número de oxidación de la especie que se reduce disminuye. El número de oxidación es un número entero que representa el número de electrones que un átomo pone en juego
El número de oxidación:
- Aumenta si el átomo pierde electrones (el elemento químico que se oxida), o los comparte con un átomo que tenga tendencia a captarlos.
- Disminuye cuando el átomo gana electrones (el elemento químico que se reduce), o los comparte con un átomo que tenga tendencia a cederlos.
Reglas para asignar el número de oxidación
- El número de oxidación de todos los elementos sin combinar es cero. Independientemente de la forma en que se representen.
- El número de oxidación de las especies iónicas monoatómicas coincide con la carga del ion.
- El número de oxidación del hidrógeno combinado es +1, excepto en los hidruros metálicos, donde su número de oxidación es –1 (ej: AlH3, LiH)
- El número de oxidación del oxígeno combinado es –2, excepto en los peróxidos, donde su número de oxidación es –1 (ej.:Na2O2, H2O2).
- El número de oxidación en los elementos metálicos, cuando están combinados es siempre positivo y numéricamente igual a la carga del ion.
- El número de oxidación de los halógenos en los hidrácidos y sus respectivas sales es –1, en cambio el número de oxidación del azufre en su hidrácido y respectivas sales es –2.
- El número de oxidación de una molécula es cero. O lo que es lo mismo, la suma de los números de oxidación de los átomos de una molécula neutra es cero.
Ajuste de ecuaciones
Todo proceso redox requiere del ajuste estequiométrico de los componentes de las semirreacciones para la oxidación y reducción.
Para reacciones en medio acuoso, generalmente se añaden:
- en medio ácido iones hidrógeno (H+), moléculas de agua (H2O), y electrones
- en medio básico hidroxilos (OH−), moléculas de agua (H2O), y electrones para compensar los cambios en los números de oxidación.
Medio ácido
En medio ácido se agregan hidronios (cationes) (H+) y agua (H2O) a las semirreacciones para balancear la ecuación final.
Del lado de la ecuación que haga falta oxígeno se agregarán moléculas de agua, y del lado de la ecuación que hagan falta hidrógenos se agregarán hidronios.
Por ejemplo, cuando el Manganeso (II) reacciona con el Bismutato de Sodio.
Ecuación sin balancear:
![]()
Oxidación : ![]()
Reducción : ![]()
Ahora tenemos que agregar los hidronios y las moléculas de agua donde haga falta hidrógenos y donde haga falta oxígenos, respectivamente.
Oxidación: ![]()
Reducción: ![]()
Las reacciones se balancearán al momento de igualar la cantidad de electrones que intervienen en ambas semirreacciones. Esto se logrará multiplicando la reacción de una semirreación por el número de electrones de la otra semirreacción (y, de ser necesario, viceversa), de modo que la cantidad de electrones sea constante.
Oxidación: ![]()
Reducción: ![]()
Al final tendremos:
Oxidación: ![]()
Reducción: ![]()
Como se puede ver, los electrones están balanceados, así que procedemos a sumar las dos semirreacciones, para obtener finalmente la ecuación balanceada.
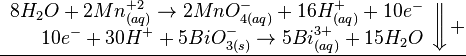
![]()
Medio básico
En medio básico se agregan iones hidróxidos (aniones) (OH−) y agua (H2O) a las semirreacciones para balancear la ecuación final.
Por ejemplo, tenemos la reacción entre el Permanganato de Potasio y el Sulfito de Sodio.
Ecuación sin balancear:
![]()
Separamos las semirreacciones en
Oxidación: ![]()
Reducción: ![]()
Agregamos la cantidad adecuada de Hidróxidos y Agua (las moléculas de agua se sitúan en donde hay mayor cantidad de oxígenos).
Oxidación: ![]()
Reducción: ![]()
Balanceamos la cantidad de electrones al igual que en el ejemplo anterior.
Oxidación: ![]()
Reducción: ![]()
Obtenemos:
Oxidación: ![]()
Reducción: ![]()
Como se puede ver, los electrones están balanceados, así que procedemos a sumar las dos semirreacciones, para obtener finalmente la ecuación balanceada.

![]()
