Espectroscopia ultravioleta-visible
La espectroscopia ultravioleta-visible o espectrofotometría ultravioleta-visible (UV/VIS) es una espectroscopia de emisión de fotones y una espectrofotometría. Utiliza radiación electromagnética (luz) de las regiones visible, ultravioleta cercana (UV) e infrarroja cercana (NIR) del espectro electromagnético, es decir, una longitud de onda entre 380nm y 780nm. La radiación absorbida por las moléculas desde esta región del espectro provoca transiciones electrónicas que pueden ser cuantificadas.
La espectroscopia UV-visible se utiliza para identificar algunos grupos funcionales de moléculas, y además, para determinar el contenido y fuerza de una sustancia.
Se utiliza de manera general en la determinación cuantitativa de los componentes de soluciones de iones de metales de transición y compuestos orgánicos altamente conjugados.
Se utiliza extensivamente en laboratorios de química y bioquímica para determinar pequeñas cantidades de cierta sustancia, como las trazas de metales en aleaciones o la concentración de cierto medicamento que puede llegar a ciertas partes del cuerpo.
Principio físico
El principio de la espectroscopia ultravioleta-visible involucra la absorción de radiación ultravioleta – visible por una molécula, causando la promoción de un electrón de un estado basal a un estado excitado, liberándose el exceso de energía en forma de calor. La longitud de onda (λ) comprende entre 190 y 800 nm.
La luz visible o UV es absorbida por los electrones de valencia, éstos son promovidos a estados excitados (de energía mayor). Al absorber radiación electromagnética de una frecuencia correcta, ocurre una transición desde uno de estos orbitales a un orbital vacío. Las diferencias entre energías varían entre los diversos orbitales. Algunos enlaces, como los dobles, provocan coloración en las moléculas ya que absorben energía en el visible así como en el UV, como es el caso del β-caroteno.
Cuando un haz de radiación UV-Vis atraviesa una disolución conteniendo un analito absorbente, la intensidad incidente del haz (Io) es atenuada hasta I. Esta fracción de radiación que ha logrado traspasar la muestra es denominada transmitancia (T) (T = I/Io). Por aspectos prácticos, se utizará la absorbancia (A) en lugar de la transmitancia (A = -logT), por estar relacionada linealmente con la concentración de la especie absorbente según la Ley de Beer-Lambert: A =ϵ·l·c (ϵ: coeficiente de absortividad molar, l: camino óptico, c: concentración de la especie absorbente).
Modos de excitación electrónica
Cuando un fotón UV-Visible de energía adecuada incide en una especie absorbente, un electrón es promovido desde su estado fundamental a un estado electrónico excitado. En absorción UV-Visible, pueden observarse las distintas transiciones electrónicas:
Transiciones σ→σ*
λ <150 nm . Este tipo de transiciones se dan sobre todo en hidrocarburos que únicamente poseen enlaces σ C-H o C-C. La energía requerida para que tenga lugar esta transición es relativamente grande, perteneciente a la región espectral denominada ultravioleta de vacío.
Transiciones n→σ *
λ entre 150-200 nm . Correspondientes a hidrocarburos que poseen átomos con pares de electrones no compartidos (electrones de no enlace). La energía necesaria para que se produzca esta transición sigue siendo alta (aunque menor que en las σ→σ*) perteneciendo éstas a la región espectral UV Lejano.
Transiciones n→π * y π→π *
λ entre 200-700 nm. La mayoría de las aplicaciones de espectroscopia UV-Visible están basadas en transiciones que ocurren en esta zona. Se requiere que las especies participantes aporten un sistema de electrones π (grupos cromóforos: compuestos con insaturaciones, sistemas aromáticos multicíclicos, etc.). Las energías de excitación en las transiciones π →π * son medianamente altas, correspondiendo a la región UV Lejano y Próximo, mientras que las n→π* son considerablemente menores, correspondiendo a la región visible del espectro.
En espectroscopia UV-Vis se irradia con luz de energía conocida suficiente como para provocar transiciones electrónicas, es decir promover un electrón desde un orbital de baja energía a uno vacante de alta energía.
Transiciones electrónicas posibles entre orbitales n: orbital que contiene par de electrones no compartidos (ejemplo en : O, N, Cl)
Las transiciones más favorecidas son entre el orbital ocupado de energia más alta (HOMO) y el orbital desocupado de energia más baja (LUMO) el espectrometro UV-Vis registra las longitudes de onda donde se registra absorción y cuantifica la absorción.
El espectro se registra como absorbancia (A) Vs. longitud de onda (Å), las bandas del espectro UV son anchas por que incluyen la estructura fina de transiciones vibracionales y rotacionales de menor energía.
El espectrofotómetro ultravioleta-visible
El espectrofotómetro es un instrumento que permite comparar la radiación absorbida o transmitida por una solución que contiene una cantidad desconocida de soluto, y una que contiene una cantidad conocida de la misma sustancia.
Todas las sustancias pueden absorber energía radiante. El vidrio, que parece ser completamente transparente, absorbe longitudes de onda que pertenecen al espectro visible; el agua absorbe fuertemente en la región del IR. La absorción de las radiaciones UV, visibles e IR depende de la estructura de las moléculas, y es característica para cada sustancia química. El color de las sustancias se debe a que absorben ciertas longitudes de onda de la luz blanca que incide sobre ellas y sólo dejan pasar a nuestros ojos aquellas longitudes de onda no absorbida.
Esta espectrofotometría utiliza radiaciones del campo UV de 80 a 400 nm, principalmente de 200 a 400 nm (UV cercano) y de luz visible de 400 a 800 nm, por lo que es de gran utilidad para caracterizar las soluciones en la región ultravioleta-visible del espectro. Se rige por una ley muy importante: la ecuación de Beer-Lambert.
Ley de Beer-Lambert
Una expresión para la ecuación de Beer-Lambert es la siguiente:
It ⁄I0=e-klc
Donde:
It, es el rango de luz captado por el tubo de fotocolorimetría,
I0, es el rango de luz que sale del tubo de fotocolorimetría y que va a llegar a la celda fotoeléctrica donde es captada y medida
k, es la capacidad de captación del haz del campo electromagnético,
l, es la longitud del tubo de fotocolorimetría, en cm.
c, es la concentración de la muestra ya ubicada en el tubo de fotocolorimetría.
La ley de Beer permite cuantificar la concentración de una muestra por UV, también puede ser expresada de la siguiente manera:
A=ε Cl
donde:
A, es la Absorbancia
ε, es el Coeficiente de extinción (Característico de cada sustancia).
l, es el Largo del paso de la cuba (cm).
C, es la Concentración (moles/l).
La zona de longitudes de onda que se registra en un espectro UV-Vis es de entre 200 y 800 nm. En esta zona no absorben dobles ni triples enlaces aislados .
Sólo van absorber enlaces π conjugados y heteroátomos con pares de electrones no compartidos (O, N), como los grupos cromóforos.
Características del sistema
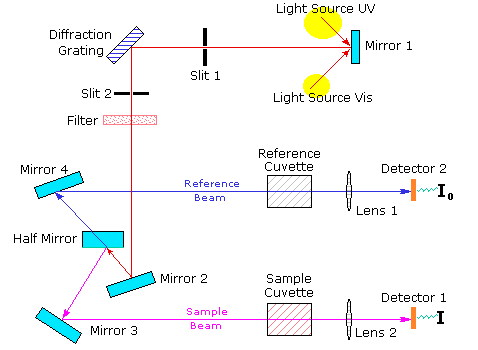
- Las muestras en solución se ponen en una pequeña celda de Si.
- Se utilizan dos lámparas: una de H o deuterio para la región UV, y una de W / halógeno para la región visible
- Se utiliza también una celda de referencia que contiene sólo solvente.
- La luz pasa simultáneamente por la celda de muestra y la celda de referencia.
- El espectrómetro compara la luz que pasa por la muestra con la que pasa por la celda de referencia.
- La radiación transmitida es detectada y el espectrómetro obtiene el espectro de absorción al barrer la longitud de onda de la luz.
Tipos de Espectrofotómetros
Espectrofotómetro de doble haz: es aquel que cuenta con dos compartimientos para celdas de muestra que le permite medir simultáneamente la cantidad de energía radiante absorbida por una matriz (blanco) y la energía absorbida por la muestra compuesta por la matriz y la especie de interés. Espectrofotómetro de haz simple: cuenta con un único compartimiento de celda con lo cual se debe realizar la medida de absorción del “blanco” para poder registrar un cero (o referencia) y luego medir la absorción de la muestra.
