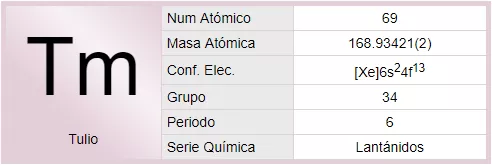
El tulio es un elemento químico de la tabla periódica cuyo símbolo es Tm y su número atómico es 69.
El Tulio es el menos abundante de los lantánidos (el prometio es menos abundante que el Tulio, pero no se lo encuentra naturalmente en la Tierra). Es un metal blando, con un lustre gris plateado brillante. A pesar de su alto precio y escasez, el tulio es utilizado como fuente de radiación en los equipos de rayos X portátiles y láseres de estado sólido.
El metal de Tulio desarrolla una pátina lentamente al ser expuesto al aire y se quema a una temperatura de 150 °C formando óxido de Tulio(III):
4 Tm + 3 O2 → 2 Tm2O3
El Tulio es bastante electropositivo y reacciona lentamente con agua fría y bastante rápido con agua caliente para formar hidróxido de Tulio:
2 Tm (s) + 6 H2O (l) → 2 Tm(OH)3 (aq) + 3 H2 (g)
El Tulio reacciona con todos los halógenos. Las reacciones son lentas a temperatura ambiente, pero vigorosas por encima de 200 °C:
2 Tm (s) + 3 F2 (g) → 2 TmF3 (s) [blanco]
2 Tm (s) + 3 Cl2 (g) → 2 TmCl3 (s) [amarillo]
2 Tm (s) + 3 Br2 (g) → 2 TmBr3 (s) [blanco]
2 Tm (s) + 3 I2 (g) → 2 TmI3 (s) [amarillo]
El Tulio se disuelve en ácido sulfúrico diluido para formar soluciones que contienen los iones verde pálido de Tm(III), los que existen como complejos de [Tm(OH2)9]3+:
2 Tm (s) + 3 H2SO4 (aq) → 2 Tm3+ (aq) + 3 SO42- (aq) + 3 H2 (g)
El Tulio reacciona con varios elementos metálicos y no-metálicos formando un conjunto de compuestos binarios, incluidos TmN, TmS, TmC2, Tm2C3, TmH2, TmH3, TmSi2, TmGe3, TmB4, TmB6 y TmB12. En estos compuestos, el Tulio presenta estados de valencia +2, +3 y +4, sin embargo, el estado +3 es más común y dicho estado es el único que se ha observado en soluciones de Tm.