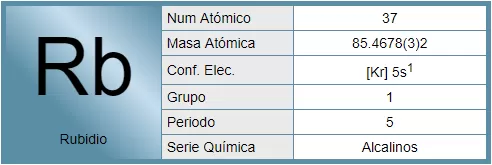
El rubidio es un elemento químico de la tabla periódica cuyo símbolo es el Rb y su número atómico es 37.
El rubidio es un metal alcalino blando, de color plateado blanco brillante que empaña rápidamente al aire, muy reactivo —es el segundo elemento alcalino menos electronegativo y puede encontrarse líquido a temperatura ambiente. Al igual que los demás elementos del grupo 1 puede arder espontáneamente en aire con llama de color violeta amarillento, reacciona violentamente con el agua desprendiendo hidrógeno y forma amalgama con mercurio. Puede formar aleaciones con oro, los demás metales alcalinos, y alcalinotérreos, antimonio y bismuto.
Al igual que los demás metales alcalinos presenta un único estado de oxidación (+1) y reacciona con dióxido de carbono, hidrógeno, nitrógeno, azufre y halógenos.
Abundancia
A pesar de no ser un elemento muy abundante en la corteza terrestre ya que se encuentra entre los 56 elementos que engloban conjuntamente un 0,05% del peso de la misma, no puede considerarse escaso.
El metal se obtiene, entre otros métodos, reduciendo el cloruro de rubidio con calcio en vacío, o calentando su hidróxido con magnesio en corriente de hidrógeno. Pequeñas cantidades pueden obtenerse calentando sus compuestos con cloro mezclados con óxido de bario en vacío.
Isótopos
Se conocen 24 isótopos de rubidio, existiendo en la naturaleza tan sólo dos, el Rb-85 y el radioactivo Rb-87. Las mezclas normales de rubidio son ligeramente radiactivas.
El isótopo Rb-87, que tiene un periodo de semidesintegración de 48,8 × 10 9 años, se ha usado mucho para la datación radiométrica de rocas. El Rb-87 decae a Sr-87 estable emitiendo una partícula beta negativa. Durante la cristalización fraccionada, el estroncio tiende a concentrarse en la plagioclasa quedando el rubidio en la fase líquida, de modo que la razón Rb/Sr en el magma residual se incrementa a lo largo del tiempo. Las mayores razones —de 10 ó más— se hallan en las pegmatitas. Si la cantidad inicial de estroncio es conocida o puede extrapolarse, midiendo las concentraciones de Rb y Sr y el cociente Sr-87/Sr-86 puede determinarse la edad de la roca. Evidentemente la edad medida será la de la roca si ésta no ha sufrido alteraciones después de su formación.
La frecuencia de resonancia del átomo de Rb-87 se usa como referencia en normas y osciladores utilizados en transmisores de radio y televisión, en la sincronización de redes de telecomunicación y en la navegación y comunicación vía satélite. El isótopo se emplea además en la construcción de relojes atómicos.
El isótopo Rb-82 se utiliza en la obtención de imágenes del corazón mediante tomografía por emisión de positrones.
Aplicaciones
El rubidio se puede ionizar con facilidad por lo que se ha estudiado su uso en motores iónicos para naves espaciales, aunque xenón y cesio han demostrado una mayor eficacia para este propósito. Se utiliza principalmente en la fabricación de cristales especiales para sistemas de telecomunicaciones de fibra óptica y equipos de visión nocturna. Otros usos son:
- Recubrimientos fotoemisores de telurio-rubidio en células fotoeléctricas y detectores electrónicos.
- Componente de fotorresistencias (o LDR, Light dependant resistors, resistencias dependientes de la luz), resistencias en las que la resistencia eléctrica varía con la iluminación recibida.
- En medicina para la tomografía por emisión de positrones, el tratamiento de la epilepsia y la separación por ultracentrifugado de ácido nucleicos y virus.
- Fluido de trabajo en turbinas de vapor.
- El RbAg4I5 tiene la mayor conductividad eléctrica conocida a temperatura ambiente de todos los cristales iónicos y podría usarse en la fabricación de baterías en forma de delgadas láminas entre otras aplicaciones eléctricas.
- Sirve para conseguir el color púrpura en los fuegos artificiales.
Precauciones
El rubidio reacciona violentamente con el agua pudiendo provocar la inflamación del hidrógeno desprendido en la reacción:
2 Rb + 2 H2O → 2 RbOH + H2
Para asegurar la pureza del metal y la seguridad en su manipulación se almacena bajo aceite mineral seco, en vacío o en atmósfera inerte.