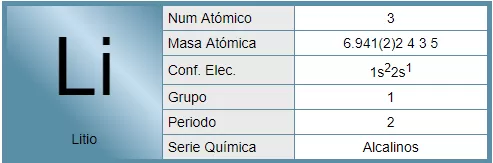
El litio es un elemento químico de símbolo Li y número atómico 3. En la tabla periódica, se encuentra en el grupo 1, entre los elementos alcalinos. En su forma pura, es un metal blando, de color blanco plata, que se oxida rápidamente en aire o agua. Su densidad es la mitad de la del agua, siendo el metal y elemento sólido más ligero.
Al igual que los demás metales alcalinos es univalente y muy reactivo, aunque menos que el sodio, por lo que no se encuentra libre en la naturaleza. Acercado a una llama la torna carmesí pero, si la combustión es violenta, la llama adquiere un color blanco brillante.
Se emplea especialmente en aleaciones conductoras del calor, en baterías eléctricas y, sus sales, en el tratamiento del trastorno bipolar.
Abundancia y obtención
El litio es un elemento moderadamente abundante y está presente en la corteza terrestre en 65 partes por millón (ppm). Esto lo coloca por debajo del níquel, cobre y wolframio y por encima del cerio y estaño, en lo referente a abundancia.
El litio, junto al hidrógeno y al helio, es uno de los únicos elementos obtenidos en el Big Bang. Todos los demás fueron sintetizados a través de fusiones nucleares en estrellas en la secuencia principal o durante estallidos de supernovas. Industrialmente se obtiene mediante la electrólisis del cloruro de litio fundido (LiCl).
Isótopos
Los isótopos estables del litio son dos, Li-6 y Li-7, siendo este último el más abundante (92.5 %). Se han caracterizado seis radioisótopos siendo los más estables el Li-8 con un periodo de semidesintegración de 838 milisegundos y el Li-9 con uno de 178.3 ms. El resto de isótopos radiactivos tienen periodos de semidesintegración menores de 8,5 ms. También se da, en laboratorio, el isótopo inestable Li-11-
Los pesos atómicos del litio varían entre 4.027 y 11.0348 uma del Li-4 y el Li-11 respectivamente. El modo de desintegración principal de los isótopos más ligeros que el isótopo estable más abundante (Li-7) es la emisión protónica (con un caso de desintegración alfa) obteniéndose isótopos de helio; mientras que en los isótopos más pesados el modo más habitual es la desintegración beta, (con algún caso de emisión neutrónica) resultando isótopos de berilio.
El Li-7 es uno de los elementos primordiales, producidos por síntesis nuclear tras el big bang. Los isótopos de litio se fraccionan sustancialmente en una gran variedad de procesos naturales, incluyendo la precipitación química en la formación de minerales, procesos metabólicos, y la sustitución del magnesio y el hierro en redes cristalinas de minerales arcillosos en los que el Li-6 es preferido frente al Li-7, etc.
Aplicaciones
Por su elevado calor específico, el litio se emplea en aplicaciones de transferencia de calor, y por su elevado potencial electroquímico constituye un ánodo adecuado para las baterías eléctricas. También se le dan los siguientes usos:
- El cloruro de litio y el bromuro de litio tienen una elevada higroscopicidad por lo que son excelentes secantes. El segundo se emplea en bombas de calor de contracción, entre otros compuestos como el nitrato de litio.
- Las sales de litio, particularmente el carbonato de litio (Li2CO3) y el citrato de litio, se emplean en el tratamiento de la manía y la depresión bipolar, así como en otras psicopatologías. Es un estabilizador del estado de ánimo. Sus mecanismos de acción son varios:
- 1. Bloquea la liberación de dopamina -bloquea la hipersensibilidad de los receptores dopaminérgicos-;
- 2. Bloquea resultados en la neurona posináptica -bloquea la reutilización de grupos fosfatos del trifosfato inositol que activa la liberación de calcio-;
- 3. Reemplaza el sodio en el canal sináptico por ser más pequeño y el potencial de acción se hace más lento, haciendo que el paciente se calme. El litio no es sustrato para la bomba sustrato sodio potasio ATPasa que impide el paso de los iones de sodio, reemplazando la concentración del sodio, lo cual en altas concentraciones puede resultar tóxico.
- El estearato de litio es un lubricante de propósito general en aplicaciones a alta temperatura.
- El litio es un agente altamente empleado en la síntesis de compuestos orgánicos, usado para la coordinación de ligandos a través del intermedio litiado.
- El hidróxido de litio se usa en las naves espaciales y submarinos para depurar el aire extrayendo el dióxido de carbono.
- Es componente común de las aleaciones de aluminio, cadmio, cobre y manganeso empleadas en la construcción aeronáutica, y se ha empleado con éxito en la fabricación de cerámicas y lentes, como la del telescopio de 5,08 m de diámetro (200 pulgadas) de Monte Palomar.
- También tiene aplicaciones nucleares.
Precauciones
Al igual que otros metales alcalinos, el litio puro es altamente inflamable y ligeramente explosivo cuando se expone al aire y especialmente al agua. Es además corrosivo por lo que requiere el empleo de medios adecuados de manipulación para evitar el contacto con la piel. Se debe almacenar en un hidrocarburo líquido como vaselina o aceite mineral. Puede generar hipotiroidismo al impedir la entrada del yodo a la hormona tiroidea.