La destilación es la operación de separar, mediante vaporización y condensación en los diferentes componentes líquidos, sólidos disueltos en líquidos o gases licuados de una mezcla, aprovechando los diferentes puntos de ebullición de cada una de las sustancias ya que el punto de ebullición es una propiedad intensiva de cada sustancia, es decir, no varía en función de la masa o el volumen, aunque sí en función de la presión.
Destilación simple o destilación sencilla:
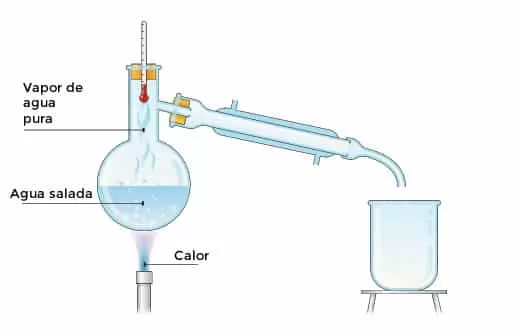
Es una operación donde los vapores producidos son inmediatamente canalizados hacia un condensador, el cual los enfría (condensación) de modo que el destilado no resulta puro. Su composición será diferente a la composición de los vapores a la presión y temperatura del separador y pueden ser calculada por la ley de Raoult. En esta operación se pueden separar sustancias con una diferencia entre 100 y 200 grados Celsius, ya que si esta diferencia es menor, se corre el riesgo de crear azeótropos. Al momento de efectuar una destilación simple se debe recordar colocar la entrada de agua por la parte de abajo del refrigerante para que de esta manera se llene por completo. También se utiliza para separar un sólido disuelto en un líquido o 2 líquidos que tengan una diferencia mayor de 50 °C en el punto de ebullición.
Destilación fraccionada de alcohol etílico:
Es una variante de la destilación simple que se emplea principalmente cuando es necesario separar líquidos con puntos de ebullición cercanos.
La principal diferencia que tiene con la destilación simple es el uso de una columna de fraccionamiento. Ésta permite un mayor contacto entre los vapores que ascienden, junto con el líquido condensado que desciende, por la utilización de diferentes “platos”. Esto facilita el intercambio de calor entre los vapores (que lo ceden) y los líquidos (que lo reciben).
Destilación al vacío:
Consiste en generar un vacío parcial por dentro del sistema de destilación para destilar sustancias por debajo de su punto de ebullición normal. Este tipo de destilación se utiliza para purificar sustancias inestables por ejemplo las vitaminas.
Lo importante en esta destilación es que al crear un vacío en el sistema se puede reducir el punto de ebullición de la sustancia casi a la mitad.
En el caso de la industria del petróleo es la operación complementaria de destilación del crudo procesado en la unidad de destilación atmosférica, que no se vaporiza y sale por la parte inferior de la columna de destilación atmosférica. El vaporizado de todo el crudo a la presión atmosférica necesitaría elevar la temperatura por encima del umbral de descomposición química y eso, en esta fase del refino de petróleo, es indeseable.
El residuo atmosférico o crudo reducido procedente del fondo de la columna de destilación atmosférica, se bombea a la unidad de destilación a vacío, se calienta generalmente en un horno a una temperatura inferior a los 400 °C, similar a la temperatura que se alcanza en la fase de destilación atmosférica, y se introduce en la columna de destilación. Esta columna trabaja a vacío, con una presión absoluta de unos 20 mm de Hg, por lo que se vuelve a producir una vaporización de productos por efecto de la disminución de la presión, pudiendo extraerle más productos ligeros sin descomponer su estructura molecular.
En la unidad de vacío se obtienen solo tres tipos de productos:
- Gas Oil Ligero de vacío (GOL).
- Gas Oil Pesado de vacío (GOP).
- Residuo de vacío.
Los dos primeros, GOL y GOP, se utilizan como alimentación a la unidad de craqueo catalítico después de desulfurarse en una unidad de hidrodesulfuración (HDS).
El producto del fondo, residuo de vacío, se utiliza principalmente para alimentar a unidades de craqueo térmico, donde se vuelven a producir más productos ligeros y el fondo se dedica a producir fuel oil, o para alimentar a la unidad de producción de coque. Dependiendo de la naturaleza del crudo el residuo de vacío puede ser materia prima para producir asfaltos
Destilación azeotrópica:
Es una de las técnicas usadas para romper un azeótropo en la destilación. Una de las destilaciones más comunes con un azeótropo es la de la mezcla etanol-agua. Usando técnicas normales de destilación, el etanol solo puede purificarse a aproximadamente el 95%.
Una vez se encuentra en una concentración de 95/5 % etanol/agua, los coeficientes de actividad del agua y del etanol son iguales, entonces la concentración del vapor de la mezcla también es de 95/5 % etanol-agua, por lo tanto destilar de nuevo no es efectivo. Algunos usos requieren concentraciones de alcohol mayores, por ejemplo cuando se usa como aditivo para la gasolina. Por lo tanto el azeótropo 95/5 % debe romperse para lograr una mayor concentración.
En uno de los métodos se adiciona un material agente de separación. Por ejemplo, la adición de benceno a la mezcla cambia la interacción molecular y elimina el azeótropo. La desventaja, es la necesidad de otra separación para retirar el benceno. Otro método, la variación de presión en la destilación, se basa en el hecho de que un azeótropo depende de la presión y también que no es un rango de concentraciones que no pueden ser destiladas, sino el punto en el que los coeficientes de actividad se cruzan. Si el azeótropo se salta, la destilación puede continuar.
Para saltar el azeótropo, el punto de éste puede moverse cambiando la presión. Comúnmente, la presión se fija de forma tal que el azeótropo quede cerca del 100 % de concentración, para el caso del etanol, éste se puede ubicar en el 97 %. El etanol puede destilarse entonces hasta el 97 %. Actualmente se destila a un poco menos del 95,5 %. El alcohol al 95,5 % se envía a una columna de destilación que está a una presión diferente, se lleva el azeótropo a una concentración menor, tal vez al 93 %. Ya que la mezcla está por encima de la concentración azeotrópica actual, la destilación no se “pegará” en este punto y el etanol se podrá destilar a cualquier concentración necesaria.
Para lograr la concentración requerida para que el etanol sirva como aditivo de la gasolina se utiliza etanol deshidratado. El etanol se destila hasta el 95%, luego se hace pasar por un tamiz molecular que absorba el agua de la mezcla, ya se tiene entonces etanol por encima del 95% de concentración, que permite destilaciones posteriores. Luego el tamiz se calienta para eliminar el agua y puede reutilizarse.
Destilación por arrastre de vapor:
Se lleva a cabo la vaporización selectiva del componente volátil de una mezcla formada por éste y otros “no volátiles”. Lo anterior se logra por medio de la inyección de vapor de agua directamente en el interior de la mezcla, denominándose este “vapor de arrastre”, pero en realidad su función no es la de “arrastrar” el componente volátil, sino condensarse en el matraz formando otra fase inmiscible que cederá su calor latente a la mezcla a destilar para lograr su evaporación. En este caso se tendrán la presencia de dos fases insolubles a lo largo de la destilación (orgánica y acuosa), por lo tanto, cada líquido se comportará como si el otro no estuviera presente. Es decir, cada uno de ellos ejercerá su propia presión de vapor y corresponderá a la de un líquido puro a una temperatura de referencia.
La condición más importante para que este tipo de destilación pueda ser aplicado es que tanto el componente volátil como la impureza sean insolubles en agua ya que el producto destilado volátil formará dos capas al condensarse, lo cual permitirá la separación del producto y del agua fácilmente.
Como se mencionó anteriormente, la presión total del sistema será la suma de las presiones de vapor de los componentes de la mezcla orgánica y del agua, sin embargo, si la mezcla a destilar es un hidrocarburo con algún aceite, la presión de vapor del aceite al ser muy pequeña se considera despreciable a efectos del cálculo:
P = Pa° + Pb°
Donde:
- P = presión total del sistema
- Pa°= presión de vapor del agua
- Pb°= presión de vapor del hidrocarburo
Por otra parte, el punto de ebullición de cualquier sistema se alcanza a la temperatura a la cual la presión total del sistema es igual a la presión del confinamiento. Y como los dos líquidos juntos alcanzan una presión dada, más rápidamente que cualquiera de ellos solos, la mezcla hervirá a una temperatura más baja que cualquiera de los componentes puros. En la destilación por arrastre es posible utilizar gas inerte para el arrastre. Sin embargo, el empleo de vapores o gases diferentes al agua implica problemas adicionales en la condensación y recuperación del destilado o gas.
El comportamiento que tendrá la temperatura a lo largo de la destilación será constante, ya que no existen cambios en la presión de vapor o en la composición de los vapores de la mezcla, es decir que el punto de ebullición permanecerá constante mientras ambos líquidos estén presentes en la fase líquida. En el momento que uno de los líquidos se elimine por la propia ebullición de la mezcla, la temperatura ascenderá bruscamente.
Si en mezcla binaria designamos por na y nb a las fracciones molares de los dos líquidos en la fase vapor, tendremos:
Pa° = na P Pb° = nbP dividiendo:
Pa° = na P = na
Pb° = nb P = nb
na y nb son el número de moles de A y B en cualquier volumen dado de vapor, por lo tanto:
Pa° = na
Pb° = nb
Y como la relación de las presiones de vapor a una “T” dada es constante, la relación na/nb, debe ser constante también. Es decir, la composición del vapor es siempre constante en tanto que ambos líquidos estén presentes.
Además como: na = wa/Ma y nb= wb/Mb
Donde: wa y wb son los pesos en un volumen dado y Ma, Mb son los pesos moleculares de A y B respectivamente. La ecuación se transforma en:
Pa° = na = waMb Pb° nb wbMa O bien: wa = MaPa° wb MbPb°
Esta última ecuación relaciona directamente los pesos moleculares de los dos componentes destilados, en una mezcla binaria de líquidos. Por lo tanto, la destilación por arrastre con vapor de agua, en sistemas de líquidos inmisibles en ésta se llega a utilizar para determinar los pesos moleculares aproximados de los productos o sustancias relacionadas.
Es necesario establecer que existe una gran diferencia entre una destilación por arrastre y una simple, ya que en la primera no se presenta un equilibrio de fases líquido-vapor entre los dos componentes a destilar como se da en la destilación simple, por lo tanto no es posible realizar diagramas de equilibrio ya que en el vapor nunca estará presente el componente “no volátil” mientras esté destilando el volátil. Además de que en la destilación por arrastre de vapor el destilado obtenido será puro en relación al componente no volátil (aunque requiera de un decantación para ser separado del agua), algo que no sucede en la destilación simple donde el destilado sigue presentando ambos componentes aunque más enriquecido en alguno de ellos. Además si este tipo de mezclas con aceites de alto peso molecular fueran destiladas sin la adición del vapor se requeriría de gran cantidad de energía para calentarla y emplearía mayor tiempo, pudiéndose descomponer si se trata de un aceite esencial.
Destilación seca.
Es la calefacción de materiales sólidos en seco (sin ayuda de líquidos solventes), para producir productos gaseosos (que pueden condensarse luego en líquidos o sólidos). Este procedimiento ha sido usado para obtener combustibles líquidos de sustancias sólidas, tales como carbón y madera. Esto también puede ser usado para dividir algunas sales minerales por termólisis, para obtención de gases útiles en la industria.