Valencia
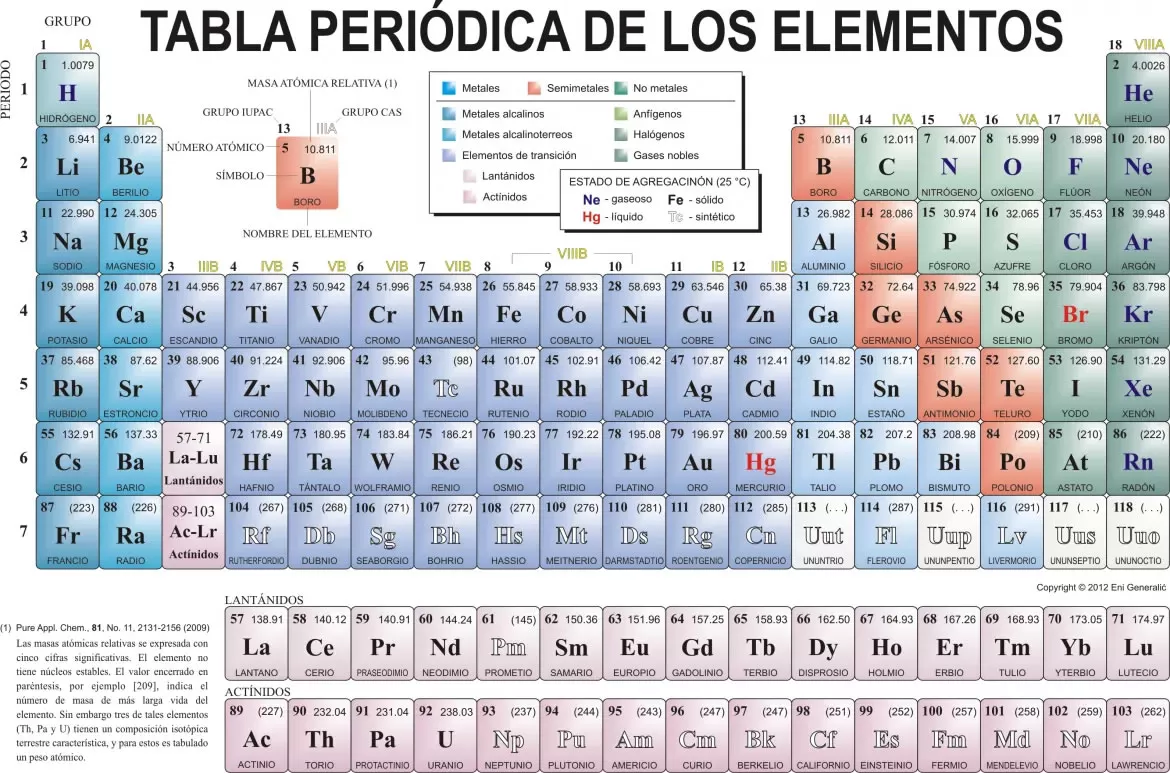
Es el número de electrones que tiene un elemento en su ultimo nivel de energía, son los que pone en juego durante una reacción química o para establecer un enlace con otro elemento. Hay elementos con mas de una valencia, por ello se reemplaza a este concepto con el de números de oxidación que a fin de cuentas representa lo mismo. A través del siglo XX, el concepto de valencia ha evolucionado en un amplio rango de aproximaciones para describir el enlace químico, incluyendo la estructura de Lewis (1916), la teoría del enlace de valencia (1927), la teoría de los orbitales moleculares (1928), la teoría de repulsión de pares electrónicos de la capa de valencia (1958) y todos los métodos avanzados de química cuántica.
Tipos de valencia
Valencia positiva máxima:
Es el número positivo que refleja la máxima capacidad de combinación de un átomo. Este número coincide con el Grupo de la Tabla Periódica al cual pertenece. Por ejemplo: el Cloro (Cl) es del Grupo VII A en la tabla, por lo que su valencia positiva máxima es 7.
Valencia negativa solo para el grupo A no para el grupo B:
Es el número negativo que refleja la capacidad que tiene un átomo de combinarse con otro pero que esté actuando con valencia positiva. Este número negativo se puede determinar contando lo que le falta a la valencia positiva máxima para llegar a 8, pero con signo -.
Estado de oxidación
Es indicador del grado de oxidación de un átomo que forma parte de un compuesto u otra especie química. Formalmente, es la carga eléctrica hipotética que el átomo tendría si todos sus enlaces a elemento distintos fueran 100% iónicos. El EO es representado por números, los cuales pueden ser positivos, negativos o cero. En algunos casos, el estado de oxidación promedio de un elemento es una fracción, tal como +8/3 para el hierro en la magnetita (Fe3O4). El mayor EO conocido es +8 para los tetroxidos de rutenio, xenón, osmio, iridio, hassio y algunos complejos de plutonio, mientras que el menor EO conocido es -4 para algunos elementos del grupo del carbono (grupo IV A).
Un átomo tiende a obedecer la regla del octeto para así tener una configuración electrónica igual a la de los gases nobles, los cuales son muy estables eléctricamente. Dicha regla sostiene que un átomo tiende a tener ocho electrones en su nivel de energía más externo. En el caso del hidrógeno este tiende a tener 2 electrones, lo cual proporciona la misma configuración electrónica que la del helio.
La electronegatividad
Es la medida de la capacidad de un átomo (o de manera menos frecuente un grupo funcional) para atraer a los electrones, cuando forma un enlace químico en una molécula. También debemos considerar la distribución de densidad electrónica alrededor de un átomo determinado frente a otros distintos, tanto en una especie molecular como en sistemas o especies no moleculares. El flúor es el elemento con más electronegatividad, el cesio es el elemento con menos electronegatividad.
La electronegatividad de un átomo determinado está afectada fundamentalmente por dos magnitudes: su masa atómica y la distancia promedio de los electrones de valenciacon respecto al núcleo atómico. Esta propiedad se ha podido correlacionar con otras propiedades atómicas y moleculares. Fue Linus Pauling el investigador que propuso esta magnitud por primera vez en el año 1932, como un desarrollo más de su teoría del enlace de valencia.La electronegatividad no se puede medir experimentalmente de manera directa como, por ejemplo, la energía de ionización, pero se puede determinar de manera indirecta efectuando cálculos a partir de otras propiedades atómicas o moleculares.
Radio covalente
Es la mitad de la distancia entre dos átomos iguales que forman un enlace covalente. Normalmente se expresa en picómetros (pm) o ángstroms (Å), donde 1 Å = 100 pm.
La suma de dos radios covalentes debería ser la longitud del enlace covalente entre los dos átomos. Sin embargo, esta relación no se cumple de forma exacta ya que el tamaño de un átomo no es constante. Este depende del entorno químico donde se encuentre. Generalmente la longitud del enlace covalente tiende a ser menor que lo que la suma de radios covalentes. En consecuencia, los valores tabulados de radios covalentes que se encuentran en la bibliografía son valores idealizados o promediados.
Radio iónico
Es, al igual que el radio atómico, la distancia entre el centro del núcleo del átomo y el electrón estable más alejado del mismo, pero haciendo referencia no al átomo, sino al ion. Éste aumenta en la tabla de derecha a izquierda por los periodos y de arriba hacia abajo por los grupos.
En el caso de los cationes, la ausencia de uno o varios electrones disminuye la fuerza eléctrica de repulsión mutua entre los electrones restantes, provocando el acercamiento de los mismos entre sí y al núcleo positivo del átomo del que resulta un radio iónico menor que el atómico.
En el caso de los aniones, el fenómeno es el contrario, el exceso de carga eléctrica negativa obliga a los electrones a alejarse unos de otros para restablecer el equilibrio de fuerzas eléctricas, de modo que el radio iónico es mayor que el atómico.
Radio atómico
Está definido como la mitad de la distancia entre dos núcleos de dos átomos adyacentes. Diferentes propiedades físicas, densidad, punto de fusión, punto de ebullición, están relacionadas con el tamaño de los átomos. Identifica la distancia que existe entre el núcleo y el orbital más externo de un átomo. Por medio del radio atómico, es posible determinar el tamaño del átomo.
Propiedades del radio atómico
- En un grupo cualquiera, el radio atómico aumenta de arriba a abajo con la cantidad de niveles de energía. Al ser mayor el nivel de energía, el radio atómico es mayor.
- En los períodos, el radio atómico disminuye al aumentar el número atómico (Z), hacia la derecha, debido a la atracción que ejerce el núcleo sobre los electrones de los orbitales más externos, disminuyendo así la distancia entre el núcleo y los electrones.
- El radio atómico puede ser covalente o metálico. La distancia entre núcleos de átomos “vecinos” en una molécula es la suma de sus radios covalentes, mientras que el radio metálico es la mitad de la distancia entre núcleos de átomos “vecinos” en cristales metálicos. Usualmente, por radio atómico se ha de entender radio covalente. Es inversamente proporcional con el átomo
Configuración electrónica
Indica la manera en la cual los electrones se estructuran o se modifican en un átomo de acuerdo con el modelo de capas electrónicas, en el cuál las funciones de ondas del sistema se expresa como un producto de orbitales antisimetrizadas. La configuración electrónica es importante porque determina las propiedades de combinación química de los átomos y por tanto su posición en la tabla periódica.
El potencial de ionización (PI) es la energía mínima requerida para separar un electrón de un átomo o molécula específica a una distancia tal que no exista interacción electrostática entre el ion y el electrón. Inicialmente se definía como el potencial mínimo necesario para que un electrón saliese de un átomo que queda ionizado. El potencial de ionización se medía en voltios. En la actualidad, sin embargo, se mide en electronvoltios (aunque no es una unidad del SI) aunque está aceptada o en julios por mol. El sinónimo energía de ionización (EI) se utiliza con frecuencia. La energía para separar el electrón unido más débilmente al átomo es el primer potencial de ionización; sin embargo, hay alguna ambigüedad en la terminología. Así, en química, el segundo potencial de ionización del litio es la energía del proceso.
En física, el segundo potencial de ionización es la energía requerida para separar un electrón del nivel siguiente al nivel de energía más alto del átomo neutro o molécula, p.
Se puede estudiar como pi=q/r , siendo q la carga del elemento y r su radio respectivo
La masa atómica (ma)
Es la masa de un átomo, más frecuentemente expresada en unidades de masa atómica unificada. La masa atómica puede ser considerada como la masa total de protones y neutrones (pues la masa de los electrones en el átomo es prácticamente despreciable) en un solo átomo (cuando el átomo no tiene movimiento). La masa atómica es algunas veces usada incorrectamente como un sinónimo de masa atómica relativa, masa atómica media y peso atómico; estos últimos difieren sutilmente de la masa atómica.
Densidad (símbolo ρ)
Es una magnitud escalar referida a la cantidad de masa en un determinado volumen de una sustancia. La densidad media es la razón entre la masa de un cuerpo y el volumen que ocupa.
Punto de ebullición
Es aquella temperatura en la cual la presión de vapor del líquido iguala a la presión de vapor del medio en el que se encuentra. Coloquialmente, se dice que es la temperatura a la cual la materia cambia del estado líquido al estado gaseoso.
La temperatura de una sustancia o cuerpo depende de la energía cinética media de las moléculas. A temperaturas inferiores al punto de ebullición, sólo una pequeña fracción de las moléculas en la superficie tiene energía suficiente para romper la tensión superficial y escapar. Este incremento de energía constituye un intercambio de calor que da lugar al aumento de la entropía del sistema (tendencia al desorden de las partículas que componen su cuerpo).
El punto de ebullición depende de la masa molecular de la sustancia y del tipo de las fuerzas intermoleculares de esta sustancia. Para ello se debe determinar si la sustancia es covalente polar, covalente no polar, y determinar el tipo de enlaces (dipolo permanente – dipolo inducido o puentes de hidrógeno).
El punto de fusión (o, raramente, punto de licuefacción)
Es la temperatura a la cual se encuentra el equilibrio de fases sólido-líquido, es decir la materia pasa de estado sólido a estado líquido, se funde. Cabe destacar que el cambio de fase ocurre a temperatura constante. El punto de fusión es una propiedad intensiva.
A diferencia del punto de ebullición, el punto de fusión de una sustancia es poco afectado por la presión y, por lo tanto, pueden ser utilizado para caracterizar compuestos orgánicos y para comprobar su pureza.
El punto de fusión de una sustancia pura es siempre más alto y tiene una gama más pequeña de variación que el punto de fusión de una sustancia impura. Cuanto más impura sea, más bajo es el punto de fusión y más amplia es la gama de variación. Eventualmente, se alcanza un punto de fusión mínimo. El cociente de la mezcla que da lugar al punto de fusión posible más bajo se conoce como el punto eutéctico, perteneciente a cada átomo de temperatura de la sustancia a la cual se someta a fusión.