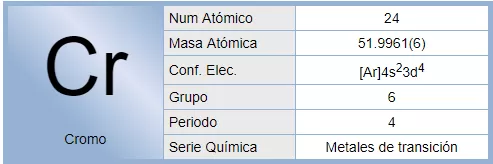
El cromo es un elemento químico de número atómico 24 que se encuentra en el grupo 6 de la tabla periódica de los elementos. Su símbolo es Cr. Es un metal que se emplea especialmente en metalurgia. Su nombre "cromo" (derivado del griego chroma, "color") se debe a los distintos colores que presentan sus compuestos.
Abundancia
Se obtiene cromo a partir de la cromita (FeCr2O4). La cromita se obtiene comercialmente calentando a la cromadora en presencia de aluminio o silicio (mediante un proceso de reducción).
Aproximadamente se produjeron en 2000 quince millones de toneladas de cromita, de la cual la mayor parte se emplea para aleaciones inoxidables (cerca del 70 por ciento), por ejemplo para obtener ferrocromo (una aleación de cromo y hierro, con algo de carbono, los aceros inoxidables dependen del cromo, y su oxido protector).
Isótopos
Se han caracterizado 19 radioisótopos, siendo el más estable el cromo-50 con un periodo de semidesintegración de más de 1,8 × 1017 años, seguido del cromo-51 con uno de 27,7025 días. El resto tiene periodos de semidesintegración de menos de 24 horas, la mayoría de menos de un minuto. Este elemento también tiene dos metaestados.
El peso atómico de los isótopos del cromo va desde 43 uma (cromo-43) a 67 uma (cromo-67). El primer modo de decaimiento antes del isótopo estable más abundante, el cromo-52, es la captura electrónica, mientras que después de éste, es la desintegración beta.
El cromo-53 es el producto de decaimiento del manganeso-53. Los contenidos isotópicos en cromo están relacionados con los de manganeso, lo que se emplea en geología.
Aplicaciones
- El cromo se utiliza principalmente en metalurgia para aportar resistencia a la corrosión y un acabado brillante.
- En aleaciones, por ejemplo, el acero inoxidable es aquel que contiene más del 12 % de cromo, aunque las propiedades antioxidantes del cromo empiezan a notarse a partir del 5 % de concentración. Además tiene un efecto alfágeno, es decir, abre el campo de la ferrita y lo fija.
- En procesos de cromado (depositar una capa protectora mediante electrodeposición). También se utiliza en el anodizado del aluminio.
- En pinturas cromadas como tratamiento antioxidante
- Sus cromatos (cromato de plomo) y óxidos (óxido de cromo III o verde de cromo) se emplean en colorantes y pinturas. En general, sus sales se emplean, debido a sus variados colores, como mordientes.
- El dicromato de potasio (K2Cr2O7) es un reactivo químico que se emplea en la limpieza de material de vidrio de laboratorio y, en análisis volumétricos, como agente valorante.
- Es común el uso del cromo y de alguno de sus óxidos como catalizadores, por ejemplo, en la síntesis de amoníaco (NH3).
- El mineral cromita (Cr2O3·FeO) se emplea en moldes para la fabricación de ladrillos (en general, para fabricar materiales refractarios). Con todo, una buena parte de la cromita consumida se emplea para obtener cromo o en aleaciones.
- En el curtido del cuero es frecuente emplear el denominado "curtido al cromo" en el que se emplea hidroxisulfato de cromo (III) (Cr(OH)(SO4)).
- Para preservar la madera se suelen utilizar sustancias químicas que se fijan a la madera protegiéndola. Entre estas sustancias se emplea óxido de cromo (VI) (CrO3).
- Cuando en el corindón (α-Al2O3) se sustituyen algunos iones de aluminio por iones de cromo se obtiene el rubí; esta gema se puede emplear, por ejemplo, en láseres.
- El dióxido de cromo (CrO2) se emplea para fabricar las cintas magnéticas empleadas en las casetes, dando mejores resultados que con óxido de hierro (III) (Fe2O3) debido a que presentan una mayor coercitividad.
Toxicología
El cromo, principalmente en forma de aleaciones y sales solubles del ión Cr [VI], ha sido utilizado ampliamente en industria durante más de un siglo. La experiencia ha demostrado que el cromo, en exposiciones excesivas, puede actuar como irritante cutáneo, como carcinógeno y como alérgeno en el ser humano. El Cr [VI] es aceptado como el principal responsable de las respuestas tóxicas mientras que los compuestos de Cr [III] han sido relacionados como irritantes pero no como carcinógenos o alérgenos.